水體黑臭成為危害城市水環(huán)境安全的重要隱患.城市水體黑臭主要是由人類向水中排入過量有機污染物, 配合水中微生物和藻類的新陳代謝, 水體缺氧致使厭氧微生物大量繁殖, 產生H2S和NH3等惡臭氣體, S2-與水中存在的Fe2+和Mn2+等離子形成黑色物質致使水體發(fā)黑.隨著各種措施的實施, 水體污染負荷大大降低, 黑臭現象有所好轉, 但氨氮難以去除的問題隨之凸現出來.
氨氮作為評價水體黑臭的重要指標之一(還包括溶解氧、氧化還原電位和透明度), 是水體中主要的耗氧物質, 也是水體富營養(yǎng)和環(huán)境污染的一種重要物質, 進入水體可促使水生動物植物大量繁殖, 造成水體缺氧, 嚴重影響水質.以游離氨形式存在的氮元素, 會作為有毒物質影響血液與氧的結合, 對魚類及其他水生生物產生負作用并通過食物鏈對人類健康造成危害.因此, 氨氮超標是現代城市水體黑臭治理過程中急需解決的問題.
吸附法以其操作方便、工藝簡單和穩(wěn)定性高等特點常被作為去除水中氮磷的有效方法, 污水處理中主要通過與污水中的氮磷之間進行物理吸附、配位體交換或表面沉淀等反應達到去除氮磷的目的.吸附材料通常有孔隙率高, 比表面積大, 吸附活性位點多等特點, 對去除污染物有著至關重要的作用.然而, 污水處理中常用吸附劑(活性炭、活性氧化鋁和硅膠等)多為人工合成或經過物理和化學改性等處理, 操作繁瑣, 生產、采購價格昂貴, 使用過程中可能會引入某些有毒有害物質, 對自然水體生態(tài)造成破壞, 造成二次污染, 因此不適合水體修復工程中大量使用.
本實驗首先選取常用的吸附氨氮的材料——沸石和活性炭, 同時經挑選, 選取礦物類吸附劑:麥飯石、硅藻土和膨潤土, 此類吸附劑也常用作吸附材料處理水中重金屬和有機染料等對環(huán)境有害物質, 且來源廣泛, 但研究其對氨氮處理效果較少.本文通過多種實驗, 模擬黑臭水體氨氮特性, 研究5種材料對氨氮的吸附特性, 旨在挑選出適合黑臭水體治理工程中可大量使用、效果明顯、價格低廉的材料.
1 材料與方法
1.1 實驗材料及預處理
本實驗采用5種不同的材料, 分別為沸石、麥飯石、硅藻土、膨潤土和活性炭.沸石和麥飯石采購于石家莊靈壽縣某礦石加工廠; 硅藻土、膨潤土和活性炭采購于國藥集團; 所有材料均通過粉碎機粉碎, 去除雜質, 過100目篩, 取篩下物于烘箱中105℃烘干24 h, 取出后置于干燥器中冷卻備用.
所使用的試劑有氫氧化鈉、鹽酸、酒石酸鉀鈉、碘化鉀、碘化汞和三氯化六氨合鈷, 均為分析純, 氯化銨為優(yōu)級純, 國藥集團生產; 溶液配制均采用新制備的去離子水; 實驗中不同濃度氨氮溶液均由氨氮儲備液稀釋而得, 儲備液配制方法:準確稱取3.819 0 g經105℃烘干的優(yōu)級純氯化銨, 溶于水中, 移入1 000 mL容量瓶中, 稀釋至標線, 得到濃度為1 000 mg·L-1的儲備液.
1.2 實驗內容
1.2.1 吸附實驗
考察5種材料對氨氮的吸附特性(動力學、等溫線、投加量和溶液pH).吸附實驗步驟為:配制特定濃度的氨氮溶液, 并使用0.1mol·L-1的NaOH和HCl溶液調節(jié)pH為特定值, 稱取0.2 g吸附材料于50 mL離心管中, 加入40 mL氨氮溶液, 置于25℃恒溫振蕩箱中以150 r·min-1進行振蕩, 一定時間后取出離心, 并測定上清液中氨氮濃度, 采用公式(1)計算材料對氨氮的單位吸附量:

式中, Qe為材料對溶液中氨氮的單位吸附量, mg·g-1; c0和ce分別為初始和吸附平衡時氨氮溶液的濃度, mg·L-1; V為溶液體積, L; m為投加的材料質量, g.
吸附動力學實驗:初始濃度為30 mg·L-1, pH為7, 振蕩時間為5~480 min.吸附等溫線實驗:初始濃度為10~250 mg·L-1, pH為7, 振蕩時間為120 min.投加量實驗:氨氮濃度為30mg·L-1, 氨氮溶液加入量為20 mL, 材料投加量為0.1~0.5 g, pH為7, 振蕩時間為120 min, 采用公式(2)計算氨氮去除率. pH影響實驗:初始濃度為30mg·L-1, pH分別為4、5、6、7、8、9和10, 振蕩時間為120 min.
式中, R為氨氮的去除率, %; c0和ce分別為初始和吸附平衡時氨氮溶液的濃度, mg·L-1; V為吸附溶液的體積, L.
1.2.2 解吸實驗
取不同濃度下吸附飽和后的材料, 使用95%的無水乙醇洗滌3次, 置于65℃電熱鼓風干燥箱中干燥24 h; 取出干燥后的材料加入40 mL的去離子水, 置于恒溫振蕩器中振蕩一定時間, 轉速150r·min-1, 取出后靜置穩(wěn)定24 h, 高速離心, 取適量上清液測定其氨氮濃度并采用公式(3)得出解吸量:
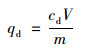
式中, qd為氨氮解吸量, mg·g-1; cd為振蕩后氨氮解吸濃度, mg·L-1; V為加入去離子水體積, L; m為材料質量, g.
1.2.3 分析方法
根據國標HJ 537-2009采用納氏試劑分光光度法測定氨氮濃度.材料表面形貌使用日本日立SU8010冷場發(fā)射掃描電鏡觀察測定.采用六氨合鈷離子交換法測定陽離子交換量(cation exchange capacity, CEC):稱取適量材料于50 mL離心管中, 加入25 mL六氨合鈷離子溶液, 密封, 置于恒溫振蕩器中, 設定溫度為25℃, 以150r·min-1振蕩交換1 h.振蕩結束, 靜置30 min, 離心取上清液于475 nm處測定吸光度并計算上清液中六氨合鈷離子濃度, 采用公式(4)計算陽離子交換量:
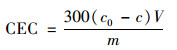
式中, CEC為材料中陽離子交換量, cmol·kg-1; c0為空白實驗濃度, mol·L-1; c為振蕩交換后溶液濃度, mol·L-1; V為浸提劑體積, mL; m為材料質量, g.
2 結果與討論
2.1 材料特性表征
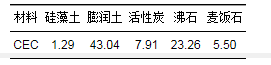
表 1為5種材料的陽離子交換量測定數據.材料中陽離子交換量值越高, 說明材料內部有大量吸附位點, 其飽和吸附量也越大.結果顯示, 膨潤土陽離子交換量值最大, 為43.04 cmol·kg-1, 最小為硅藻土, 1.29 cmol·kg-1.
表 1 5種材料陽離子交換量值/cmol·kg-1
5種材料的掃描電鏡結果如圖 1所示. 圖 1(a)、1(b)為沸石電鏡, 可以看出材料表面粗糙, 凹凸不平, 呈魚鱗狀.從圖 1(c)看出麥飯石微觀呈不規(guī)則狀(片狀、塊狀等), 表面致密, 截面出現不同程度的褶皺, 未觀察到微孔等其他特殊結構.相比之下, 硅藻土的微觀結構較規(guī)則[圖 1(d)], 呈圓盤狀, 材料表面布滿孔徑不一且粗糙的微孔, 這可能是由于其表面存在過多的雜質和有機物. 圖 1(e)中, 電鏡下的膨潤土形如紙團狀結構, 邊緣不規(guī)則并且有著輕微彎曲, 電鏡結果與Mo等的研究結果一致.實驗所采用的活性炭[圖 1(f)]多為不規(guī)則塊狀, 活性炭表面未發(fā)現孔狀結構, 因此活性炭對氨氮的吸附可能是通過活性炭活化過程中產生的化學基團進行的.
圖 1

2.2 吸附特性分析
2.2.1 吸附動力學
5種材料的動力學研究中分別采用3種動力學方程進行擬合, 擬合曲線見圖 2, 擬合參數見表 2.通過3種不同吸附動力學方程擬合氨氮吸附過程, 可以識別材料的吸附機制.本文采用準一級動力學方程、準二級動力學方程以及顆粒內擴散方程對實驗數據進行擬合.
圖 2
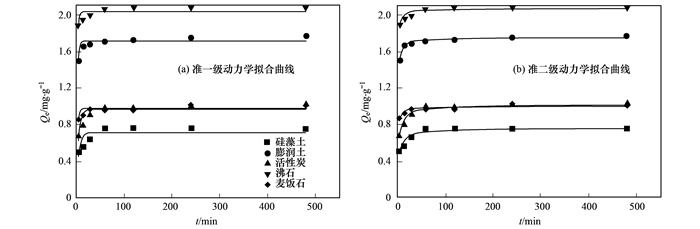
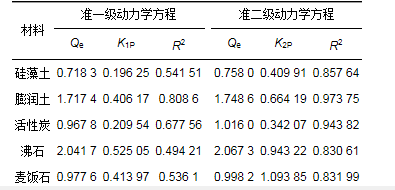
表 2 5種材料對氨氮吸附的動力學擬合參數
![]()
準二級動力學方程(Pseudo-second-order)表示為:
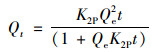
顆粒內擴散方程(Intrapartide diffusion model)表示為:
式中, Qt為t時刻的吸附量, mg·g-1; t為吸附時間, min; Qe為平衡時刻的吸附量, mg·g-1; K1P為準一級動力學方程的吸附速率常數, min-1; K2P為準二級動力學方程的吸附速率常數, g·(mg·min)-1; K3P為顆粒內擴散速率常數, mg·(g·min0.5)-1; c為經驗常數, 與邊界層厚度相關, c值越大邊界層效應越大.
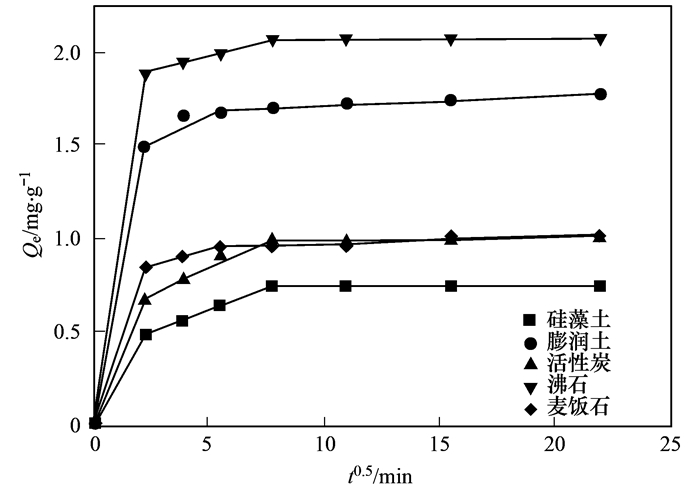
從圖 2中可得出, 5種吸附材料對水中氨氮的吸附分為快速吸附過程和吸附平衡過程.快速吸附過程, 0~120 min, 選取的材料吸附量隨時間增加而增加, 快速吸附主要由于材料本身有著大量的吸附空閑位點, 隨著吸附過程的進行, 空閑吸附位點迅速被NH4+占據, 形成快速吸附階段; 120 min過后, 5種材料吸附量不再隨時間增加而增加, 在一定范圍內波動, 即判定為吸附平衡階段.平衡階段的出現是由于材料層間可交換的陽離子全部被水中的NH4+交換, 吸附位點全部被占據.通過研究材料吸附污染物的動力學, 可以將其吸附過程控制在較短時間, 提高效率、降低能耗.對比5種材料的平衡吸附量, 沸石平衡吸附量最大, 達到2.07mg·L-1, 其次為膨潤土, 麥飯石, 活性炭和硅藻土, 平衡吸附量分別為1.77、1.03、1.02和0.75 mg·L-1.
5種材料擬合得到的參數見表 2.從中可知, 準一級動力學方程對5種材料擬合得到的R2均在0.81以下, 且整體低于準二級動力學方程擬合得到的R2值.同時, 準二級動力學擬合方程計算得到的平衡吸附量更加接近實驗得到的最大吸附量, 分別為2.067 3、0.998 2、0.758 0、1.748 6和1.016 0 mg·L-1.因此, 準二級動力學擬合方程更加準確地描述了實驗材料吸附的全過程, 可以判斷5種材料對氨氮的吸附以化學吸附為主.
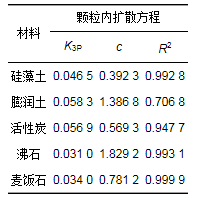
為了更好地了解材料的擴散機制, 采用顆粒內擴散模型來分析其機制.根據顆粒內擴散模型理論, 若Qt與t0.5曲線為通過原點的直線, 則顆粒內擴散為吸附速率唯一限制因素; 若Qt與t0.5曲線為不通過原點的直線, 則顆粒內擴散為吸附速率的限制因素.如圖 3所示, 5種材料對氨氮吸附分為3個階段.第一階段為表面的快速吸附, 由于NH4+迅速穿過邊界層擴散至材料表面, 迅速在表面聚集, 并與材料表面結合形成了一條過原點的直線; 第二階段進入吸附速率放緩的擴散階段, 氨氮分子向材料內部孔隙進行擴散吸附, 導致圖中第二階段斜率下降, 吸附速率放緩; 第三階段則為吸附平衡期, 主要原因是材料內外部吸附位點全部被分子占據.由于第一、三階段為表面聚集和平衡階段, 因此表 3列出的為第二階段緩慢吸附擬合后的參數.公式(7)中c表示方程的截距, 通過計算, 5種材料的c值全部為非零值, 表明緩慢吸附階段, 顆粒內擴散不是影響材料吸附氨氮的唯一因素.具體聯系污水寶或參見http://www.dowater.com更多相關技術文檔。
圖 3
2.2.2 吸附等溫線
吸附等溫線是描述體系中吸附劑表面和溶液中吸附質數量關系的曲線.本實驗通過Langmuir和Freundlich等溫方程對不同材料的吸附數據進行擬合并研究. Langmuir公式為理論公式, 根據吸附的物質只有一層分子厚的假定推導出來的, 由于吸附劑表面積是一定的, 公式中必然會出現吸附量的極限值. Freundlich公式則屬于經驗公式, 用來描述多層分子吸附的過程.對于吸附的實驗數據, 通過作圖來求出對應常數以確定更加符合何種等溫模型.兩種模型分別表述如下.
Langmuir等溫吸附公式可表述為:
Freundlich等溫吸附模型可以表述為:
式中, Qe為單位質量吸附量, mg·g-1; ce為平衡溶液中氨氮的濃度, mg·L-1; Qm為最大吸附量, mg·g-1; KL和KF表示吸附表面強度的常數, L·mg-1; n為吸附強度指標.
此外, 通過分離因子RL可以判斷所用吸附材料是否有效吸附水中污染物[19]:
式中, c0為溶液中氨氮初始濃度, mg·L-1; RL值受吸附質起始值濃度影響, 當0 < RL < 1, 判斷為有利吸附(優(yōu)惠吸附); RL>1為不利吸附(非優(yōu)惠吸附); RL=1為線性吸附; RL=0為不可逆吸附.
Langmuir和Freundlich擬合曲線見圖 4.從中可知, 隨著溶液中氨氮初始濃度的增加, 材料的平衡吸附量也隨之增高, 高濃度下, 吸附量增加較緩慢, 這是由于單位吸附材料隨著初始濃度的增高能夠與更多的NH4+接觸.隨后, NH4+在有效吸附位點趨于飽和, 吸附速率放緩. 表 4為2種等溫吸附模型對不同材料的擬合后得出的參數.從中可知, 硅藻土Langmuir方程擬合相關系數R2大于Freundlich方程擬合相關系數, 因此硅藻土對氨氮的吸附類型為單層吸附.此外, Langmuir模型中KL的值代表材料表面的吸附結合能, 5種材料的KL值由大到小為沸石, 麥飯石, 硅藻土, 膨潤土和活性炭, 擬合結果與實驗所得結果不一致.而其他4種材料則符合Freundlich等溫方程, 屬于多層分子吸附.對比其它擬合相關系數R2, 其它4種材料則更加符合Frendlich等溫方程, 為多層分子吸附. Freundlich模型中KF越大, 吸附容量越大.沸石KF值最大, 對溶液中氨氮的吸附量也最大, 其他4種材料依次為麥飯石, 膨潤土, 活性炭和硅藻土, 所得結果與實驗一致, 因此Freundlich更好地描述了材料對氨氮的吸附.
圖 4
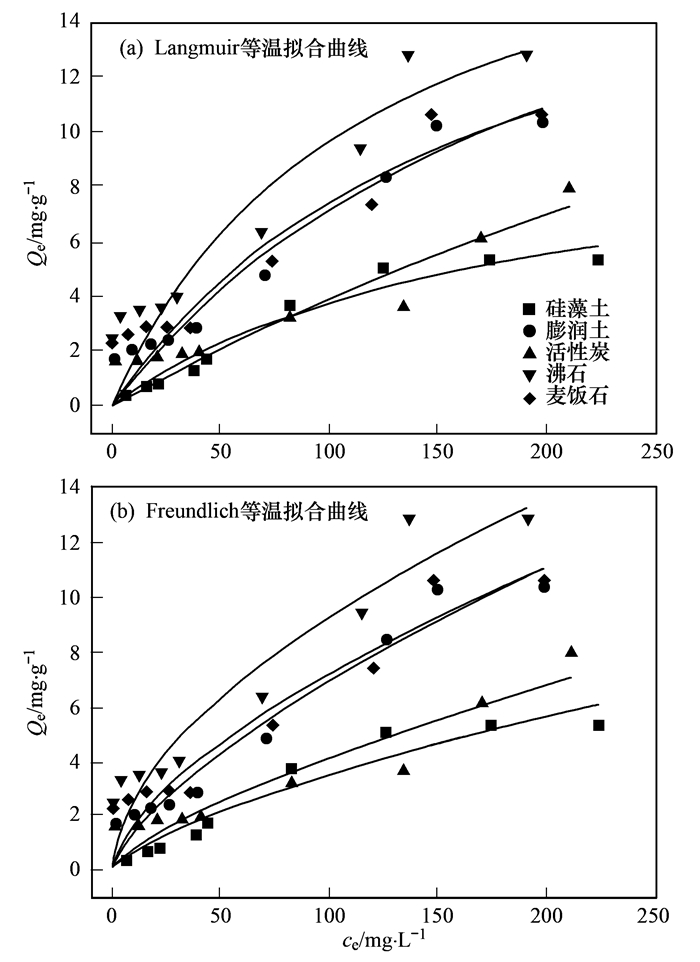
表 4 5種材料對氨氮吸附等溫方程擬合參數
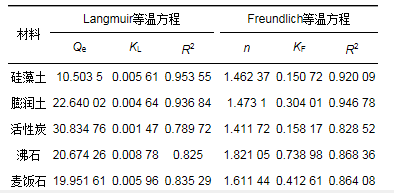
由圖 5可知, 5種材料的RL隨氨氮初始濃度增加而減小, 值均在0~1之間, 表明吸附為有利吸附.同時, 模型中n作為吸附強度指標, n < 1屬于差吸附, 1 < n < 2為難度適中的吸附, 2 < n < 10屬于良好吸附.由表 4可知, 5種材料中的n值在1~2之間, 為難度適中的吸附.
圖 5
動力學和等溫線測定結果與陽離子交換量數據有所不同, 而陽離子交換量通常是由層間可交換性陽離子及斷面破鍵水解吸附陽離子共同貢獻的.通常情況下, 沸石, 膨潤土等礦石材料骨架由不同形式的硅酸鹽或硅氧結構組成, 其中的硅被鋁或其他金屬代替, 使得其微觀結構帶有負電荷, 與Na+等陽離子結合, 聚集在材料內部. 5種材料中膨潤土的CEC值高于沸石, 但其吸附量卻低于沸石.從圖 1可知, 膨潤土外觀邊緣不規(guī)則并且有著輕微彎曲, 致使表面附著更多的陽離子, 而這些陽離子并未在平衡骨架電性中起到作用, 在振蕩實驗中也與六氨合鈷離子發(fā)生交換.同時也可推測出膨潤土對氨氮有效吸附位點位于層間隙和微孔中.活性炭通常對污染物吸附通過范德華力或者化學鍵, 表面通過范德華力結合部分的陽離子會與六氨合鈷離子發(fā)生交換, 但對氨氮的去除并未起到太大作用.硅藻土表面層由雜質和有機物構成, 使得表面微孔孔徑不一, 少量的陽離子存在于表面的微孔中, 減弱對氨氮吸附的能力.
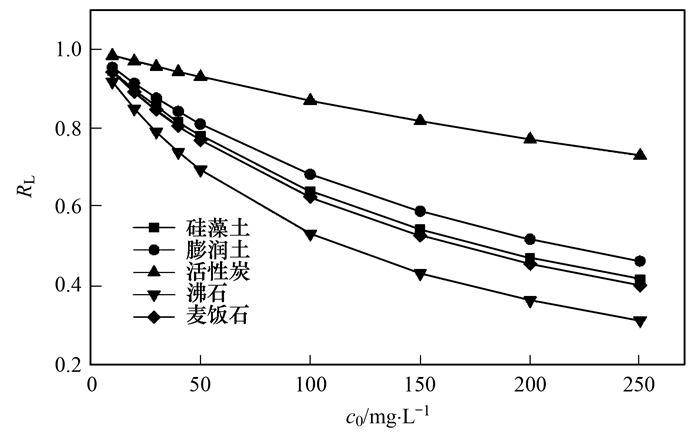
2.2.3 不同投加量對氨氮的去除效果
圖 6為5種材料不同投加量對氨氮吸附的影響.從中可知, 隨著投加量的增加, 硅藻土、膨潤土、活性炭和沸石對水中氨氮的吸附效果隨著增加, 投加量為0.5g時, 氨氮去除率最大, 4種材料對吸附水中氨氮去除率分別為10.46%、49.25%、16.87%和100%.當麥飯石投加量為0.4g時, 去除率最高為48.85%, 然而投加量為0.5g時, 對氨氮去除率下降至39.2%.這個現象出現可能是在材料投加量少時, NH4+會大量聚集在材料顆粒與顆粒之間, 這樣, 吸附向有利方向進行, 即NH4+被材料吸附; 隨著材料的投加量增加, 顆粒之間的距離減小, 使得NH4+存在空間減小, 不利于NH4+與吸附位點結合, 導致吸附量減小.
圖 6
2.2.4 不同初始pH對氨氮去除影響
考察pH對氨氮吸附的影響, 結果如圖 7.溶液pH是影響吸附效果的重要條件, H+或者OH-在溶液中可能會改變吸附劑表面電荷. 5種材料在堿性條件下均得到最高的吸附量.沸石和麥飯石隨著pH升高, 其吸附量先增加后減少, 在pH=8時得到最大吸附量, 為4.27mg·g-1和3.42mg·g-1.硅藻土、膨潤土和活性炭在整個pH范圍內緩慢增長, 在pH=10時取得最大值分為別1.26、1.85和1.49 mg·g-1.在酸性條件下, 材料表面被H+質子化, NH4+與材料表面發(fā)生排斥, 降低了材料對NH4+的結合力; 隨著pH升高, 質子化作用減弱, 吸附量也隨之升高并至最大值; 同時NH4+在水中與NH3·H2O發(fā)生公式(11)和(12)的轉化, NH4+含量逐漸減少, 與內部陽離子交換能力被削弱, 吸附量減小.因此pH值很大程度上會影響對氨氮的吸附.
圖 7

2.3 解吸特性分析
吸附材料對氨氮吸附飽和后在水中的解吸性能是選擇材料的重要依據, 通過解吸能力可以判斷材料的穩(wěn)定性.對于5種材料的解吸實驗, 從圖 8和圖 9中看出解吸量全部隨初始濃度的升高而升高.初始濃度的增高, 溶液和材料表面及內部形成濃度差, 所形成的濃度差為NH4+擴散提供動力, 首先快速聚集至材料表面, 然后向材料內部遷移, 濃度越大導致NH4+能量越大, 向內部遷移速率也就越大, 導致材料吸附量增大的同時, 吸附飽和后也使NH4+在材料表面形成聚集, 不能向內部遷移.解吸條件下, 在表面積累或處于遷移狀態(tài)下的NH4+隨初始濃度增加而增加, 因此5種材料解吸的NH4+量隨初始濃度增加而增加.
圖 8

圖 9
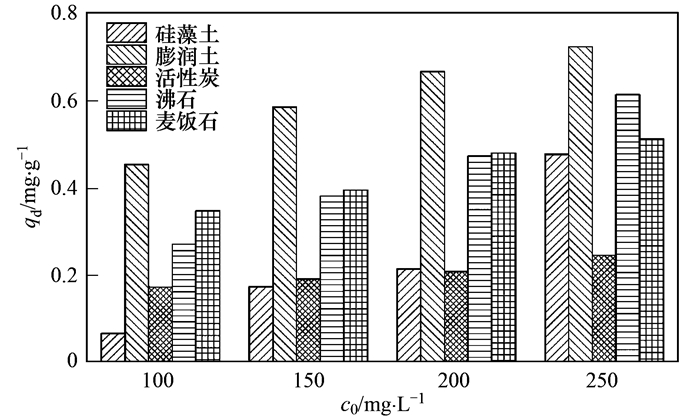
結合陽離子交換量和表面微觀結構分析, 膨潤土微觀結構表面及邊緣不規(guī)則容易在表面附著不能進行有效交換的陽離子, 表面未有效結合的NH4+在振蕩過程中脫離材料表面重新進入水體, 導致膨潤土解吸量最大, 造成二次污染.沸石、麥飯石表面褶皺等結構使其具有較大比表面積, 表面會附著聚集NH4+, 隨著初始濃度升高, 附著在表面的NH4+較多, 解吸量較大, 但低于膨潤土, 由于二者吸附量較大, 解吸量所占比例較小; 相比于硅藻土和活性炭, 表面結構單一, CEC值小, 致使其吸附量、解吸量都很低.
3 結論
(1) 通過對材料吸附數據的擬合, 5種材料對氨氮的吸附均符合準二級動力學方程, 以化學吸附為主; 顆粒內擴散影響其吸附過程, 但非唯一控制因素; 通過對等溫吸附數據擬合, 硅藻土更適合Langmuir等溫方程, 為單層分子吸附, 而其他4種材料更加符合Freundlich等溫方程, 則為多層分子吸附.
(2) 氨氮去除率隨投加量增加而提高. 5種材料對于低濃度氨氮去除有良好效果, 均適合輕度黑臭水體氨氮的去除; 沸石更加適合用于重度黑臭水體中氨氮的去除.
(3) 不同pH條件下, 沸石和麥飯石對氨氮的吸附量先增加后減少, 在pH=8時取得最大吸附量; 其他3種材料在實驗pH值范圍內吸附量緩慢升高.
(4) 5種材料相對比, 膨潤土解吸能力較強, 不適合長時間吸附水中氨氮; 硅藻土和活性炭吸附量小, 解吸能力弱, 可在水體中長時間吸附氨氮; 沸石和麥飯石吸附量大, 解吸能力適中, 工程中材料選取可視實際情況選擇.